行业动态首页 > 新闻动态 > 行业动态
本期为大家带来的是我国科学家在生命科学领域的最新研究进展,希望读者朋友们能够喜欢。
1. Nat Med:中国科学家发现新型前列腺癌生物标志物 有望改善癌症的个体化疗法

近日,一项发表在国际杂志Nature Medicine上的研究报告中,来自中国复旦大学和梅奥诊所的研究人员通过联合研究鉴别出了前列腺癌对疗法产生耐受性的一种新机制,相关研究或为后期开发新型前列腺癌疗法提供思路和希望。文章中,研究者解释了SPOP基因中的突变在前列腺癌对药物产生耐受性上所扮演的关键角色,SPOP基因突变是原发性前列腺癌中出现最为频繁的遗传突变,这些突变在癌症对BET抑制剂药物产生耐受性上扮演着重要的角色。
BET(bromodomain and extra-terminal domain,溴域和额外末端结构域)抑制剂是一类能够抑制BET蛋白活性的药物,而这些蛋白能够帮助指导癌细胞的异常生长。作为一种疗法,BET抑制剂非常具有治疗潜力,但经常会发生药物耐受性。前列腺癌是美国男性最常患的恶性肿瘤之一,其也是引发美国男性死亡的第三大癌症,改善前列腺癌的治疗是美国重大的公共健康目标之一。
研究者表示,SPOP基因的突变能够稳定BET蛋白抵御BET抑制剂的活性,而且该基因突变还能够促进癌细胞增殖、侵袭及生长;研究者Haojie Huang博士表示,本文研究发现对于后期开发前列腺癌的新型疗法具有非常重要的意义,因为SPOP突变或BET蛋白表达水平的升高都能够用作生物标志物,来改善BET抑制剂导向疗法治疗SPOP突变或BET蛋白过表达相关癌症的效率。SPOP突变也能够被用来指导前列腺癌患者的抗癌疗法。
本文的研究要点如下:
BET蛋白(BRD2、BRD3和BRD4)是SPOP基因真正的降解基质;
SPOP基因的突变能够诱发前列腺癌患者样本中BET蛋白表达水平的升高;
SPOP基因突变体的表达会诱发对BET抑制剂耐药,同时还会激活AKT-mTORC1通路,促进癌变细胞的生长和存活;
共同施用AKT抑制剂能够帮助克服SPOP突变的前列腺癌对BET抑制剂的耐药性,梅奥诊所技术商业化部门Mayo Clinic Ventures在前列腺癌生物标志物和疗法开发上拥有一项专利技术。
2. PLoS Negl Trop Dis:中国科学家重大发现!航空旅行或是登革热病毒在亚洲各国扩散的"元凶"

尽管在过去10年里很多感染性疾病的发病率都明显下降了,但登革热病毒暴发的次数和病例数却一直在上升;日前,刊登在国际杂志PLOS Neglected Tropical Diseases上的一篇研究报告中,来自北京师范大学等机构的研究人员通过研究发现,登革热扩散到新的区域在很大程度上可能是航空旅行所致。
每年在全球登革热病毒都会影响大约3.9亿人群的健康,而且还会引发一系列疾病症状,比如低烧、头痛、甚至严重的低血压等,这种病毒几乎会引起地球热带和亚热带区域人群致病,但2014年日本登革热的暴发却打破了这种模式,总的来讲,近些年来登革热所影响的地理区域在不断扩张。
这项研究中,北师大和牛津大学的研究人员通过联合研究分析了从1956年至2015年期间亚洲登革热病毒的扩散情况,他们收集了过去59年来自亚洲20个国家或区域的2202份登革热病毒遗传序列样本,并对其分析来确定不同毒株的之间的相关性,随后他们还调查了航空旅行、海上移动、迁移及社会经济来确定影响登革热扩的风险因子。
结果表明,相比研究数据揭示的其它因子而言,三种不同的登革热病毒血清型(DENV-1、DENV-2、DENV-3)的扩散和空中交通密切相关;诸如泰国和印度等空中交通枢纽或许还能够帮助登革热病毒的流行,而中国、柬埔寨、印尼和新加坡则能够将登革热病毒扩散到亚洲其它国家。
最后研究者表示,未来全球流动性的趋势或许能够潜在加速登革热在全球的出现和扩散,而对登革热的流行进行有效地预防和控制需要我们对登革热病毒的地理分布有更好地理解,尤其是一些热带国家。
3. Mol Psych:重大发现!中国科学家阐明新型毒品改变大脑的可塑性机制
近日,中国科学家袁逖飞教授团队通过研究发现,新型毒品的滥用会影响大脑可塑性,并损伤皮层的学习功能。相关研究成果发表在精神病学领域的顶尖期刊Molecular Psychiatry(影响因子13.2)上。
这项研究中,研究人员首先在甲基苯丙胺(冰毒)自身给药的大鼠模型上进行了行为学研究与电生理记录,特异性地鉴定了皮层到背外侧纹状体通路的可塑性损伤。他们发现,可塑性损伤的可能分子机制是突触上出现了含有GluN3A蛋白的NMDA受体。该类受体对钙离子通透性较弱,因此会极大地改变突触可塑性。该可塑性相对应的运动学习功能也受到了扰乱。
研究人员进一步在吸食冰毒的成瘾人群中进行了转化验证研究。与南京大连山强制隔离戒毒所合作,研究团队结合了非侵入的经颅磁刺激与表面肌电电生理记录,对上述皮层-背外侧纹状体通路进行可塑性记录。数据显示,吸食冰毒的成瘾人群皮层可塑性也出现了损伤,并出现了一定的运动学习障碍。而在戒毒康复的个体中,相关可塑性得到了一定的恢复。这提示皮层可塑性可能为成瘾康复效果评定提供了重要指标。大脑可塑性大脑适应环境并对自身调整的重要能力,也是大脑参与学习、记忆、发育与修复过程中不可缺少的机制。袁逖飞研究团队的前期工作报道了海洛因等传统毒品成瘾者伴随了皮层可塑性损伤(http://news.bioon.com/article/6684420.html)。本研究则是世界上首次对新型毒品滥用引起的皮层可塑性进行评定与机制研究。以经颅磁刺激为基础结合肌电、脑电、脑成像技术的非侵入脑功能测评,可能为各类神经与精神疾病的诊断与治疗追踪提供有力的手段。
该研究由袁逖飞教授牵头,合作团队有北京大学薛言学副教授、澳门大学苏焕兴教授、江苏省人民医院沈滢主任、南京大连山强制隔离戒毒所曹新玉警官等,研究项目得到国家自然科学基金等项目资助。
4. Nat Commun:中国科学家开发出全新容积化学成像技术 有望实现非侵入性早期疾病诊断
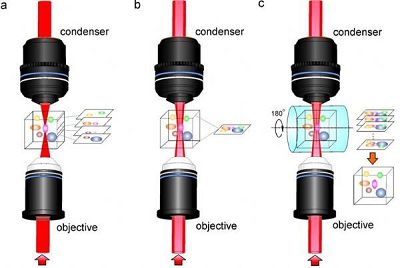
近日,来自中国西安电子科技大学生物光学成像研究组的研究人员通过研究开发了一种全新的成像技术:受激拉曼投影显微和断层成像术(Stimulated Raman projection microscopy and tomography);这一技术结合了受激拉曼散射显微成像免标记以及贝塞尔光束穿透深的优点,使得在不采用荧光标记情况下的三维容积成像成为可能。相关成果以"Volumetric Chemical Imaging by Stimulated Raman Projection Microscopy and Tomography"为题发表在近日的国际杂志Nature Communications上。
受激拉曼投影成像利用一对贝塞尔光束代替传统受激拉曼散射显微镜中的高斯光束作为激发源照射样品。相比于高斯光束,贝塞尔光束可以在较长的一段距离内保持聚焦状态,因此可以在一段细长的圆柱聚焦体积内(直径:亚微米-微米,长度:几百微米-毫米)产生受激拉曼信号。通过在样本后收集受激拉曼信号沿光束传播方向的累积信号,同时结合二维平面扫描技术、断层成像技术和样本旋转技术,该研究团队建立了受激拉曼投影显微和断层成像方法,可快速地定量三维体积内的化学成分及其分布信息。
"三维容积化学成像能够让人们更好地理解复杂三维生物系统中的化学组分,"论文的第一作者,西安电子科技大学的陈雪利博士说,"这种技术利用一种称为贝塞尔光束的特殊光束,这种光束能够比用于其他成像技术中的传统高斯光束提供更长的聚焦长度,使得其更容易穿透深层组织。受激拉曼投影成像避免使用荧光染料,同时能够产生更准确的数据,因为它可以直接对整个体积进行成像,而不是通过深度扫描进行信号叠加。"
"得益于贝塞尔光束的长聚焦距离和焦点自我修复特性,受激拉曼投影成像技术更适合于深度组织成像,在大尺度样本成像中具有优越的定量能力和快速的三维成像能力。"论文通讯作者,美国普渡大学的程继新教授补充道,"这一技术有望突破已有显微成像技术在样本尺度上的瓶颈,在研究细胞新陈代谢、脑功能、发育生物学等领域具有重要应用价值,有望实现避免采集血液样本进行药物测试或靶标筛选,从而实现非侵入式的早期疾病诊断。"
5. Cell Res:科学家利用猴子模型取得自闭症研究新进展

自闭症是一种常见的神经发育紊乱疾病,主要症状为社交行为首先以及出现重复性的行为。目前全球范围对自闭症研究兴趣越来越高,而且随着大规模外显子测序技术的发展,一些新型的与自闭症有关的基因也被鉴定出来。
SHANK3结构域的突变是最典型的一类人类自闭症相关遗传缺陷。遗传改造过的突变体小鼠是研究该蛋白在自闭症发病过程中的病理学功能的最佳工具。然而,由于人与小鼠的大脑存在明显的区别, 因此小鼠模型中得出的结论往往难以适用于临床实践。最近,来自中科院遗传与发育研究所张永清博士课题组首次利用SHANK3缺陷型猴子模型发现了其神经发育的障碍。
利用CRISPR/Cas9技术,作者将猕猴胚胎中的SHANK3基因进行改造,成功得到了三个存在独特基因突变的后代,之后他们通过免疫组化等方式分析了猴子的各个组织中基因的突变情况。后续的试验表明,SHANK3的突变会导致突触后蛋白质,例如GluN2B、PSD95、mGluR5等的下调,并且会导致Homer1b/c在细胞中的聚集。此外,突变体猴子的大脑前叶区成熟的神经元数量有明显降低,而星形细胞的数量则有明显增加。这些发现表明SHANK3蛋白对于灵长类动物大脑的早期发育具有重要的作用,揭示其具体的作用机制能够促进对自闭症领域的了解。
相关结果发表在最近一期的《Cell Research》杂志上,文章题目为"Altered neurogenesis and disrupted expression of synaptic proteins in prefrontal cortex of SHANK3-deficient non-human primate"
6. Science:科学家们发现调控"痒"感觉的中枢神经回路
痒的确是一种十分令人不爽的感觉,使我们不由自主地想去挠;另一方面,痒也是动物自我保护的一种重要机制。然而,慢性的发痒(常见于皮肤病与肝脏疾病患者中)会导致抓痒的行为失去控制,进而造成严重的皮肤或组织的损伤,因此它是一个值得关注的临床问题。
目前临床上对于治疗慢性发痒的手段十分有限,其中原因是缺乏对其中具体机制的了解。因此,发痒的信号转导对于神经学家们来说是一个十分值得研究的方向。最近一些研究提高了我们对痒的感觉信号在脊髓中传输的机制的理解,但大脑是如何传递这一信号的仍不太清楚。
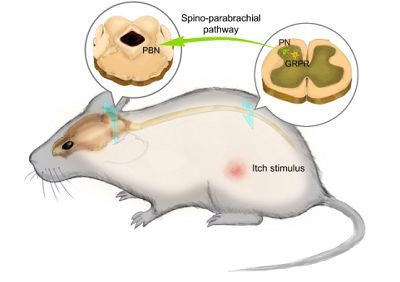
最近,来自中国科学院神经学研究所的孙衍刚博士课题组发现了痒信号在大脑中传递的中枢神经回路特征。利用光遗传学、化学遗传学、膜片钳以及体内纤维光度测定技术,研究者们证明了"脊髓-臂旁区(spino-parabrachial)"信号对于痒信号从脊髓向大脑传递十分关键,并且他们鉴定出了臂旁核(PBN)是第一个负责痒信号的中枢中转站。相关结果发表在《Science》杂志上。
首先,研究者们分析了脊髓神经元是如何将痒信号传递到大脑中的。脊髓神经元能够表达PGPR这一类受体,后者被认为对痒信号的传递具有重要的作用。作者发现脊髓中表达GRPR的神经元并不会直接将信号传递到大脑,而PBN则会在这一过程中被激活。进而他们推测脊髓中的GRPR神经元或许能够与PBN有连接,从而将痒信号间接性地传递到PBN中。
为了验证这一猜想,研究者们构建了在GRPR神经元中特异性表达光敏通道蛋白的转基因小鼠。通过光照能够诱导GRPR神经元激活并且进一步诱导PBN的激活,这一结果证明脊髓中的GRPR神经元能够激活PBN。此外,研究者们还检验了"脊髓-臂旁区"通路对于痒信号的传递是否有作用。通过光遗传学的手段,作者发现人为地抑制脊髓-臂旁区的信号活性能够阻断小鼠挠痒的行为。此外,研究者们再次确认了PBN在痒信号传递中的作用。他们发现PBN的活性在痒信号传递过程中得到了增强。在行为层面,通过抑制PBN的活性,小鼠挠痒的行为同样能够得到抑制,表明PBN对于痒信号的传递的重要性。总之,在这项研究中,作者们发现了痒信号从脊髓到大脑的关键神经回路。这一发现表明PBN是痒信号的第一个关键中枢站。如果后续研究能够进一步揭示其中的分子机制,那么将有助于慢性发痒症状的治疗。
7. Science:开发出一种强力胶粘剂,有望修复多种潮湿的组织遭受的损伤
曾经试图将创可贴粘在潮湿的皮肤上的任何人都知道结果是令人失望的。对医用胶粘剂来说,湿皮肤并不是唯一的挑战:人体充满着血液、血清和其他的液体,它们都会使得对众多内部损伤的修复复杂化。如今使用的很多胶粘制品对细胞是有毒性的,当处于干燥时,它们缺乏弹性,而且不能够强力地结合到生物组织上。
如今,在一项新的研究中,来自中国清华大学和美国哈佛大学等研究机构的研究人员制造出一种超强的"强力胶粘剂(tough adhesive)"。这种强力胶粘剂是生物相容性的,能够结合到组织上,而且这种结合强度与人体自身的有弹性的软骨相比拟,此外即便当组织湿润时,这种强力胶粘剂也能够发挥作用。相关研究结果发表在2017年7月28日的Science期刊上,论文标题为"Tough adhesives for diverse wet surfaces"。
论文通信作者、哈佛大学威斯生物启发工程研究所(Wyss Institute for Biologically Inspired Engineering)创始核心成员、哈佛大学约翰-保尔森工程与应用科学学院(John A. Paulson School of Engineering and applied Sciences, SEAS)教授Dave Mooney博士说,"我们的强力胶粘剂的关键特征是将一种非常强的粘合力与转移和释放压力的能力结合在一起。在此之前,这种整合是不能在一种胶粘剂中实现的。"
当论文第一作者Jianyu Li博士(之前是威斯生物启发工程研究所的博士后研究员,如今是加拿大麦吉尔大学的一名助理教授)开始思考如何改进现有的医用胶粘剂时,他意想不到地在鼻涕虫中发现了一种液体。一种被称作Dusky Arion(学名:Arion subfuscus)的鼻涕虫在美国的部分地区和欧洲比较常见。当遭受威胁时,它会分泌一种特殊的粘液,就地将它自己胶粘起来,从而使得捕食者很难将它从它胶粘的表面上撬开。科学家们之前已确定这种胶粘物由一种坚韧的基质组成,而且这种基质上布满着带电荷的蛋白。这就启发Li和他的同事们构建一种强力胶粘剂,这种强力胶粘剂是双层水凝胶,由一种藻酸盐-聚丙烯酰胺基质层和由这种基质层支撑着的一种粘合剂层组成,这种粘合剂层具有从它的表面上伸出去的带正电荷的聚合物。
这些带正电荷的聚合物通过三种机制结合到生物组织上:静电吸引到带负电荷的细胞表面上,相邻原子间形成的共价键和物理渗透,这就使得这种胶粘剂非常强力。但是,这种基质层同样重要,Li说,"大多数之前的材料设计仅关注组织和胶粘剂之间的界面。我们的强力胶粘剂能够通过它的基质层消散能量,这就能够让它在断裂之前大量变形。"
Mooney团队设计的这个基质层含有钙离子,这些钙离子通过离子键结合到这种藻酸盐水凝胶上。当给这种强力胶粘剂施加压力时,这些"具有牺牲精神的"离子键首先被打开,从而允许基质层在它的结构被破坏之前吸收大量的能量。在实验性测试中,相比于其他的医用胶粘剂,需要三倍多的能量来破坏这种强力胶粘剂的粘合,而且当这种破坏发生时,仅这种水凝胶本身遭到破坏,这种强力胶粘剂与组织之间的粘合并未受到破坏,这就证实这种强力胶粘剂具有史无前例的高粘合强度和基质韧性。
这些研究人员在多种干燥的和潮湿的猪组织(包括皮肤、软骨、心脏、动脉和肝脏)上测试他们的强力胶粘剂,结果发现它比其他的医用胶粘剂显著更强力地结合到所有的这些组织上。当移植到大鼠体内两周后,或者当被用来密封猪心脏上的洞后通过机械手段让该猪心脏膨胀和收缩随后让它遭受数万轮拉伸,这种强力胶粘剂仍然维持它的稳定性和粘合性。此外,当在发生肝破裂出血的小鼠中使用时,它并不导致组织损伤,而且也不会粘合到周围的组织上,但是万能胶和一种商业的基于凝血酶的胶粘剂的使用会导致这些副作用产生。
这种高性能的强力胶粘剂在医学领域具有众多潜在的应用,比如作为补片(patch),能够被切割成合适的大小,用于组织表面上,或者作为一种可注射的溶液,将它注射到更深的损伤部位中。它也能够被用来将医学设备附着到它们的靶结构(如心脏)上。论文共同作者Adam Celiz博士(如今是英国帝国理工学院生物工程系的一名讲师)说,"这种强力胶粘剂具有广泛的应用。我们能够利用生物可降解的材料制造这种强力胶粘剂,因此一旦完成它们的任务,它们就降解。我们甚至能够将这种技术与软机器人技术(soft robotics)相结合,制造出粘性机器人,或者将这种技术与药物相结合,制造出一种新的药物运送载体。"
8. Nature:清华大学科学家发现T细胞重编程新方法,有助治疗一系列免疫疾病
当免疫系统因过度活跃的细胞或抑制它的功能的细胞而失去平衡时,它导致一系列疾病,如牛皮癣和癌症等。通过操纵某些被称作T细胞的免疫细胞的功能,人们可能有助恢复免疫系统的平衡和开发出靶向这些疾病的新疗法。
在一项新的研究中,来自中国清华大学、美国格拉斯通研究所、加州大学旧金山分校和Agios 制药公司的研究人员首次揭示出一种重编程特定T细胞的方法。更加准确地说,他们发现如何将增强免疫系统的促炎性T细胞转化为抑制免疫系统的抗炎性T细胞,而且反之亦然。相关研究结果于2017年8月2日在线发表在Nature期刊上,论文标题为"Metabolic control of TH17 and induced Treg cell balance by an epigenetic mechanism"。论文通信作者为清华大学药学院院长丁胜(Sheng Ding)教授、清华大学医学院的董晨(Chen Dong)教授和Agios 制药公司的Edward M. Driggers。丁胜同时也是加州大学旧金山分校药物化学教授和格拉斯通研究所高级研究员。
这些研究人员研究了两类细胞:效应T细胞,激活免疫系统让我们的身体抵抗不同的病原体;调节性T细胞,协助控制免疫系统,阻止它攻击周围的健康组织。丁胜教授说,"我们的发现可能对自身免疫疾病治疗、干细胞疗法和免疫肿瘤学疗法产生重大的影响。"通过利用药物开发上的专业知识,丁胜课题组鉴定出一种小分子药物能够成功地将效应T细胞重编程为调节性T细胞。他们的研究详细地描述了一种协助将一种细胞类型转化为另一种细胞类型的代谢机制。这种重编程T细胞的方法可能具有几项医学应用。比如,在自身免疫疾病中,效应T细胞被过度激活,从而给身体造成损伤。将这些效应T细胞转化为调节性T细胞可能有助降低这种过度激活,让免疫系统恢复平衡,因而治疗这种疾病的根源。此外,这项研究可能改进基于干细胞的疗法。至少在理论上,产生调节性T细胞可能促进免疫耐受性,阻止人体对新植入的细胞产生免疫排斥。
论文第一作者、丁胜实验室博士后研究员Tao Xu解释道,"我们的研究也可能促进人们努力开展免疫肿瘤学研究和开发癌症疗法。这类疗法并不直接靶向癌症,而是激活免疫系统,这样它就能够识别癌细胞,并且攻击它们。"
很多癌症通过控制调节性T细胞来抑制免疫系统,从而产生一种肿瘤能够生长且不会被检测出来的环境。在这种情况下,丁胜课题组的发现可能被用来将调节性T细胞转化为效应T细胞从而增强免疫系统,因此,它能够更好地识别和摧毁癌细胞。
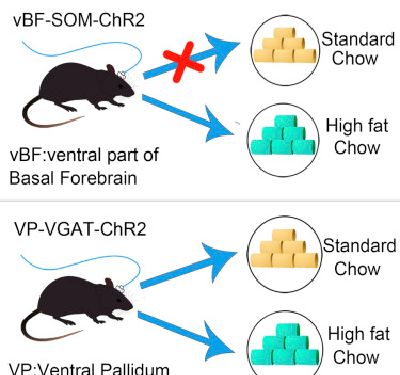
9. Cell Rep:清华科学家发现促进高脂饮食摄入的特殊神经元
肥胖是一个全球性问题,很多人认为食物摄入过多是导致肥胖的主要原因。但是影响食物摄入的可调节性神经回路还没有得到充分的研究。在一项发表在国际学术期刊Cell Reports上的研究中,来自清华大学麦戈文脑科学研究院的宋森研究院带领研究团队发现位于基底前脑的生长激素抑制素神经元(somatostatin neurons,SOM)和伽马氨基丁酸能神经元(GABAergic neurons,VGAT)在调节进食方面发挥着特定作用。
就目前来说,人们可以轻松获得相对便宜且可口并富含能量的食物,不用担心食物匮乏,这是导致肥胖流行的一个非常关键的环境因素。有研究认为在这种环境下享乐饮食行为是导致食物过度摄取的主要贡献力量,在这种情况下食物的摄入并非代谢所需而是受进食过程中的奖赏体验所推动。许多科学家对于神经对进食的调控进行了大量研究,但是哪些特定神经元群体负责脂肪摄入的调控目前还不清楚。
在这项研究中,研究人员利用光遗传学技术刺激小鼠基底前脑的SOM神经元发现能够在几分钟内增加脂肪和蔗糖的摄取并促进小鼠产生类似焦虑的行为。他们又进一步通过光遗传技术刺激基底前脑的SOM神经元向下丘脑外侧区发出的投射,发现能够导致对脂肪的选择性摄入。除此之外,激活基底前脑的VGAT神经元可以快速诱导小鼠对食物摄取的增加以及啃咬行为。
研究人员通过对全脑的输入和输出信号进行匹配研究发现基底前脑的SOM神经元可以与其他参与进食和情绪调节的脑部区域形成双向的连接。
总得来说,这些研究结果表明基底前脑的SOM神经元在进食方面发挥着选择性调控作用。
来源:生物谷